北京大学基础医学院李文强老师等近期在《Nature Communications》(IF:15.7)上发表了《The inner nuclear membrane protein LEMD3 organizes the 3D chromatin architecture to maintain vascular smooth muscle cell identity》文章,启衡星特色产品STAR-Click新生转录本捕获试剂盒(FS-L1004)有幸参与其中,为该研究贡献一份力量!

北京大学基础医学院李文强老师等近期在《nature communications》(IF:15.7)上发表了《The inner nuclear membrane protein LEMD3 organizes the 3D chromatin architecture to maintain vascular smooth muscle cell identity》文章,启衡星特色产品(STAR-Click新生转录本捕获试剂盒(FS-L1004)有幸参与其中,为该研究贡献一份力量!

一、研究背景
血管平滑肌细胞(VSMCs)的收缩表型对维持血管稳态至关重要。在病理刺激下,VSMCs 会发生表型转换,失去收缩能力,转而获得增殖和迁移能力,从而促进动脉粥样硬化、内膜新生等血管疾病的发生。尽管已知转录因子和表观遗传修饰参与调控这一过程,但染色质三维结构在维持VSMC身份中的作用尚不明确。
本文通过全基因组CRISPR筛选,发现LEMD3可能是维持VSMC收缩表型的潜在调控因子,VSMC中LEMD3缺乏会导致收缩表型丧失,并加剧小鼠的血管损伤后内膜新生。此外,蛋白结合组分析表明,LEMD3会与CBX3相互作用,随后将异染色质锚定在细胞核外周。基于Hi-C数据的分子动力学模拟分析,LEMD3缺失会扰乱染色质结构。多组学分析进一步揭示,LEMD3 缺失导致A和B区室(常/异染色质)边界处的TAD(拓扑相关结构域)间相互作用增加,这与染色质可及性降低以及VSMC收缩基因表达受抑制相关。该研究揭示,内核膜蛋白LEMD3通过将异染色质锚定在核周来维持染色质三维结构,从而维持血管平滑肌细胞的收缩表型。

图1、LEMD3 在组织三维染色质结构中以维持血管平滑肌细胞(VSMCs)收缩表型中的作用示意图。
二、研究内容与主要发现
- 全基因组CRISPR筛选发现LEMD3是维持血管平滑肌收缩表型的调控因子
-
-
- 研究者构建了带有 ACTA2-EGFP 报告基因的 MOVAS 细胞系,通过全基因组CRISPR筛选,发现敲低Lemd3会导致EGFP表达下降,提示其与VSMC收缩表型相关。
- 在体外实验中,敲低 Lemd3 会导致收缩标志物(如 ACTA2、CNN1、TAGLN)表达下降,细胞形态由梭形变为多边形,收缩能力减弱,增殖能力增强。
- LEMD3缺失加重小鼠血管损伤后内膜新生
-
-
- 构建平滑肌特异性 Lemd3 敲除小鼠(Lemd3 SMKO),发现其主动脉收缩能力下降,血管损伤后内膜新生加剧,进一步证实LEMD3在维持VSMC收缩表型和抑制血管病变中的作用。
- LEMD3与CBX3相互作用,介导异染色质锚定于核周
-
-
- 通过蛋白质互作组学分析,发现LEMD3与CBX3(识别异染色质H3K9me2/3修饰的阅读器)结合。
- LEMD3通过其RRM结构域与CBX3相互作用,将异染色质锚定在核外周;敲低 Lemd3 会导致异染色质从核周向核内重新分布。
- LEMD3 调控三维染色质结构
-
-
- 通过 Hi-C 和三维染色质建模发现,Lemd3 缺失会导致:
- A/B 区室边界处的TAD间相互作用增强
- 染质可及性下降
- 色收缩相关基因表达下调
- 多组学整合分析(RNA-seq、ATAC-seq、ChIP-seq)进一步证实,这些变化与 VSMC 收缩功能的丧失密切相关。
三、研究意义
- 首次揭示核内膜蛋白通过三维基因组结构调控VSMC表型
本研究首次将核内膜蛋白LEMD3与染色质三维结构调控联系起来,拓展了对VSMC表型维持机制的理解。
- 提出“异染色质锚定—三维结构—基因表达—细胞功能”新通路
LEMD3–CBX3–异染色质锚定–TAD 间相互作用–染色质可及性–基因表达,这一通路为理解细胞身份维持提供了新视角。
LEMD3 调控的基因中包括多个与冠状动脉疾病相关的 GWAS 位点,提示其异常可能与人类血管疾病相关。
四、主要研究成果
- 通过系统性 CRISPR筛选+多组学分析,确立了LEMD3是维持VSMC收缩表型的关键因子。
- 揭示了LEMD3–CBX3互作在异染色质空间定位中的作用,连接了核膜蛋白与染色质结构。
- 首次在 VSMC 中阐明TAD间相互作用在基因表达调控中的功能,丰富了三维基因组学在血管生物学中的研究。
- 研究整合了分子生物学、遗传学、生物信息学和生物物理学方法,展现了多学科交叉的研究范式。
五、新生RNA捕获(nascent RNA capture)在这篇文章中起到了辅助功能性验证的作用:
- 验证LEMD3缺失对收缩基因转录的直接抑制作用
-
-
- 发现LEMD3敲低后,Tagln和Acta2的新生RNA水平显著下降;
- 表明这些基因的转录活性受LEMD3调控,而非由mRNA稳定性变化引起;
- 强化了“染色质结构变化 → 转录抑制”这一因果链条。
- 支持“染色质可及性下降导致转录抑制”的机制
-
-
- ATAC-seq显示LEMD3缺失后Tagln/Acta2启动子区域开放性下降;
- 新生RNA捕获进一步证实这些基因转录活性确实被抑制;
- 两者结合,构成染色质结构 → 可及性 → 转录输出的完整证据链。
- 排除转录后调控干扰,聚焦“转录层面”机制
-
-
- 在VSMC表型转变中,部分基因表达变化可能由RNA稳定性或翻译效率变化引起;
- 新生RNA捕获帮助作者聚焦于转录起始/延伸阶段,排除转录后调控干扰;
- 使研究机制更具因果性和直接性。
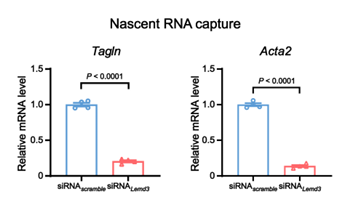
图2、LEMD3敲低后,Tagln和Acta2的新生RNA水平显著下降。
六、总结
本研究不仅深化了对血管平滑肌细胞身份维持机制的理解,也为探索三维染色质结构在细胞分化和疾病中的作用提供了新思路。LEMD3 作为一个连接核膜与染色质结构的关键分子,未来可能成为干预血管重塑和相关疾病的潜在靶点。



